TÜV SÜD als zweite Benannte Stelle nach MDR anerkannt (FOTO)
(ots) -
TÜV SÜD Product Service wurde von der Zentralstelle der Länder für
Gesundheitsschutz bei Arzneimitteln und Medizinprodukten (ZLG) als
eine der ersten Benannten Stellen weltweit für die neue
Medizinprodukteverordnung (MDR) anerkannt. Mit der MDR hat das
Europäische Parlament das europäische Zulassungssystem für
Medizinprodukte weiter verbessert. Die Verordnung trat im Mai 2017 in
Kraft. Die Übergangsfrist endet am 25. Mai 2020.
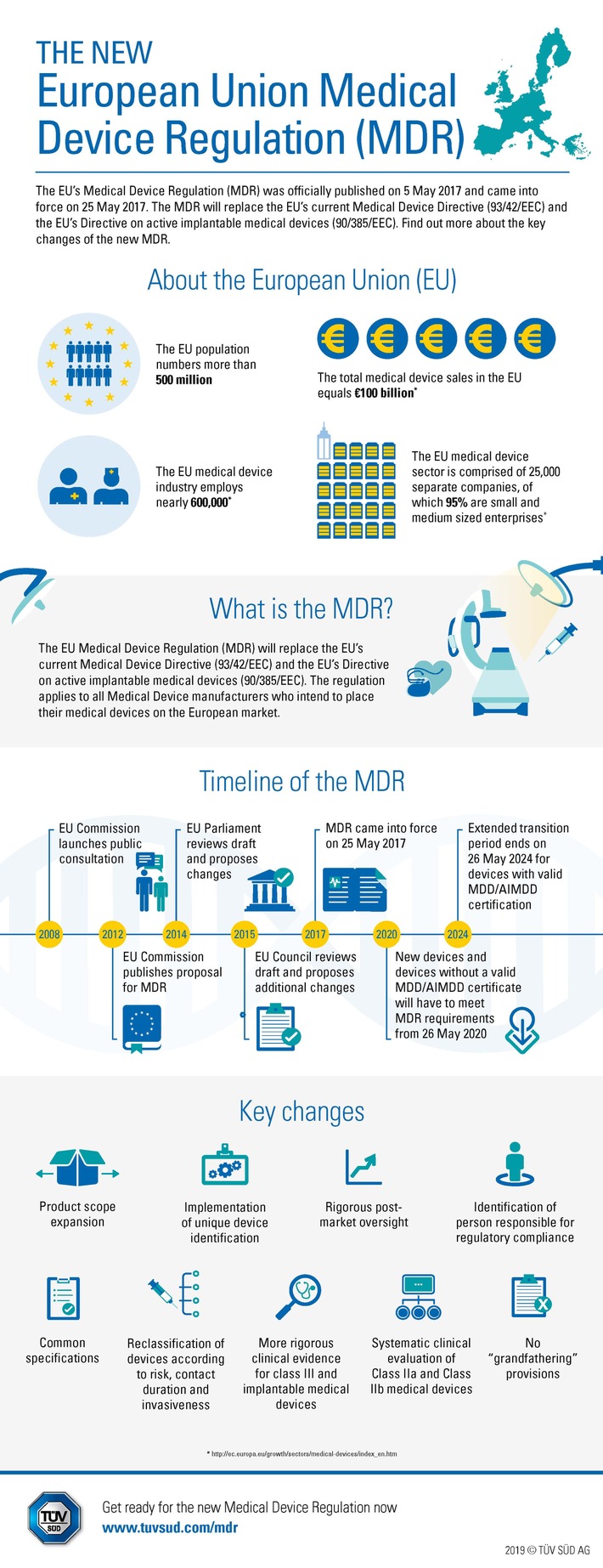
Strengere Anforderungen an Hersteller und Benannte Stellen Die
neue Medical Device Regulation (MDR, EU 2017/745) der Europäischen
Union ersetzt die Richtlinie 93/42/EWG Medical Device Directive (MDD)
und 90/385/EWG Active Implantable Medical Devices (AIMD). "Die
Verordnung gilt für alle Medizinproduktehersteller, die ihr Produkt
auf den europäischen Markt bringen wollen. Sie stellt hohe
Anforderungen an Medizinproduktehersteller und an die Benannten
Stellen, die Hersteller für die Konformitätsbewertung von
Medizinprodukten hinzuziehen müssen (ausgenommen hiervon sind
Medizinprodukte der Risikoklasse I, für die eine "Selbsterklärung"
des Herstellers genügt). Wir sind stolz darauf, dass TÜV SÜD die
strengen Anforderungen der MDR erfüllt und weltweit eine der ersten
Benannten Stellen ist, die Zertifizierungen nach der neuen MDR
durchführen kann", sagt Dr. Royth von Hahn, Global Head of Medical &
Health Services (MHS) der TÜV SÜD Product Service.
Die Zahl der Benannten Stellen, die aktuell den Benennungsprozess
durchlaufen, hat sich gegenüber der Zahl der Benannten Stellen für
die Medizinprodukterichtlinie (MDD) reduziert. Lediglich 39 der
aktuell 58 Benannten Stellen haben einen Antrag auf Neubenennung für
die MDR gestellt. Von diesen 39 Bewerbern wurden bislang 23 auditiert
und TÜV SÜD wurde jetzt als zweite Benannte Stelle für die MDR
anerkannt.
Die wichtigsten Änderungen mit der MDR
Im Gegensatz zu EU-Richtlinien (Directives) sind Verordnungen
(Regulations) unmittelbar anwendbar und müssen nicht in nationales
Recht umgesetzt werden, was das Risiko von Auslegungsunterschieden in
den einzelnen EU-Staaten verringert. Die neue MDR soll die Qualität
und Sicherheit von Medizinprodukten auf dem EU-Markt weiter
verbessern. Zu diesem Zweck wurden die Anforderungen an alle
Beteiligten und insbesondere die Hersteller von Medizinprodukten
präzisiert und verschärft.
Überblick: Das ändert sich mit der MDR für die Hersteller
Präzisierte und verschärfte Anforderungen an:
- den Inhalt und den Umfang der Technischen Dokumentation zu einem
Produkt sowie das Qualitätsmanagement eines Herstellers.
- klinische Bewertungen sowie klinische Prüfungen, insbesondere
mit Blick auf Art, Umfang und Qualität der klinischen Daten.
- die Überwachung von Produkten nach dem Inverkehrbringen, die
fortlaufend in die Bewertung der Produkte einfließt.
Mehr Dokumentationspflichten sowie Berichtspflichten gegenüber den
Behörden und den Benannten Stellen (Post Market Surveillance
Plan/Report, Post Market Clinical Follow-up Report, Periodic Safety
Update Report, Summary of Safety and Clinical Performance).
Vorgaben zur eindeutigen Registrierung, Identifikation und
Nachverfolgung von Medizinprodukten (Unique Device Identification,
UDI).
Die neue MDR bietet keinen Bestandsschutz. Auch Produkte, die
bereits auf dem Markt sind, müssen die neuen Anforderungen erfüllen
und den gleichen Konformitätsbewertungsprozess durchlaufen wie neue
Produkte. "Hersteller von Medizinprodukten sind gut beraten, sich
schnell über die Anforderungen der neuen MDR und über die Fristen zu
informieren. TÜV SÜD empfiehlt Herstellern von bereits zugelassenen
Medizinprodukten, sich mit ihren Benannten Stellen in Verbindung zu
setzen, um ihre Konformitätsbewertung nach den neuen Anforderungen zu
planen. Dies ist von größter Wichtigkeit, da die Zahl der Benannten
Stellen, die die entsprechenden Dienstleistung anbieten und erbringen
können, künftig begrenzt sein wird. Umfassende Vorbereitung und
frühzeitige Maßnahmen sind der Schlüssel für einen reibungslosen
Übergang auf die neuen Anforderungen" betont Dr. Bassil Akra, Vice
President, Global Strategic Business Development of Medical & Health
Services (MHS) bei TÜV SÜD Product Service.
Die Rolle der Benannten Stellen nach der EU-Verordnung
Grundsätzlich ist der Hersteller dafür verantwortlich, dass sein
Medizinprodukt den gesetzlichen Vorgaben entspricht. Bei
Medizinprodukten höherer Risikoklassen muss der Hersteller eine
Benannte Stelle in den Zulassungsprozess einbeziehen. Benannte
Stellen müssen von einer staatlichen Aufsichtsbehörde benannt und von
der EU-Kommission notifiziert werden. Die Unabhängigkeit der
Benannten Stellen wird durch das System der Benennung und der damit
verbundenen fortwährenden Überwachung und regelmäßigen Neubewertung
durch die Aufsichtsbehörden sichergestellt.
Internationale Expertise von TÜV SÜD
TÜV SÜD ist eine der größten Benannten Stellen für die Zulassung
von Medizinprodukten weltweit. Über 750 Medizinprodukte-Experten von
TÜV SÜD sind an mehr als 30 Standorten vertreten. Die Hersteller
profitieren sowohl von der technischen, wissenschaftlichen und
klinischen Kompetenz als auch von umfassenden internationalen
Akkreditierungen wie NRTL, INMETRO oder Medical Device Single Audit
Programm (MDSAP). Dadurch lässt sich der Aufwand für den Zugang zu
internationalen Zielmärkten vereinfachen und die Time-to-Market
verkürzen. Das Medical Device Single Audit Programm (MDSAP) ist ein
Projekt des International Medical Device Regulators Forum (IMDRF). Es
schafft die Möglichkeit, durch ein einziges Qualitätsmanagement-Audit
die regulatorischen Anforderungen in mehreren Ländern zu erfüllen:
Australien, Brasilien, Japan, Kanada und den USA.
Weitere Informationen zur EU-Medizinprodukteverordnung, die
wichtigsten Änderungen und zu den Leistungen von TÜV SÜD gibt es
unter http://ots.de/BPLq8z.
Hinweis für Redaktionen: Die Pressemeldung und das Bild in
reprofähiger Auflösung können heruntergeladen werden unter
www.tuev-sued.de/pressemeldungen.
Pressekontakt:
Dirk Moser-Delarami
TÜV SÜD AG
Unternehmenskommunikation
Westendstr. 199, 80686 München
Tel.+49 (0) 89 / 57 91 - 15 92
Fax+49 (0) 89 / 57 91 - 22 69
E-Maildirk.moser-delarami(at)tuev-sued.de
Internet www.tuev-sued.de
Original-Content von: TÜV SÜD AG, übermittelt durch news aktuell
Themen in diesem Fachartikel:
Unternehmensinformation / Kurzprofil:
Datum: 23.05.2019 - 12:00 Uhr
Sprache: Deutsch
News-ID 1723293
Anzahl Zeichen: 0
Kontakt-Informationen:
Ansprechpartner:
Stadt:
München
Telefon:
Kategorie:
Handel
Anmerkungen:
Dieser Fachartikel wurde bisher 57 mal aufgerufen.
Der Fachartikel mit dem Titel:
"TÜV SÜD als zweite Benannte Stelle nach MDR anerkannt (FOTO)
"
steht unter der journalistisch-redaktionellen Verantwortung von
T (Nachricht senden)
Beachten Sie bitte die weiteren Informationen zum Haftungsauschluß (gemäß TMG - TeleMedianGesetz) und dem Datenschutz (gemäß der DSGVO).




